Veileder om internasjonale standarder for legemiddelinformasjon
Anbefalinger og tiltak om standarder for legemiddelinformasjon
Formål og bruksområde
Formålet med veilederen er å gjøre helse- og omsorgssektoren kjent med hvilke internasjonale standarder som finnes på legemiddelområdet og hvor disse bør brukes.
Veilederen dekker internasjonale standarder for samhandling om legemiddelinformasjon mellom aktører og systemer.
Veilederen beskriver hvilke standarder som bør brukes til ulike formål og hvilke tiltak som bør gjennomføres for å sikre at standardene blir tatt i bruk på en enhetlig måte.
Veilederen gjelder for
Målgruppene for veilederen er:
- leverandører av legemiddelinformasjon
- leverandører av kunnskaps- og beslutningsstøtte for legemiddelbruk
- eiere av nasjonale e-helseløsninger
- nasjonal tjenesteleverandør
I tillegg er det viktig at følgende målgrupper kjenner til internasjonale standarder som er relevante for dem, og vurderer dem ved utvikling eller bestilling av nye systemer og løsninger:
- leverandører av system med legemiddelinformasjon, som for eksempel EPJ-, kurve-, apotek-, lager- og pakkesystem
- bestillere av system med legemiddelinformasjon
- eiere av helse- og kvalitetsregistre
Bakgrunn
Internasjonale standarder for bedre informasjonsflyt
Legemiddelinformasjon deles i dag i mindre grad enn ønsket, både mellom fagsystemer i én virksomhet og mellom aktørene på legemiddelområdet. Eksempler på dette er mellom kurvesystemer og nasjonale e-helsetjenester og mellom leverandører av kunnskaps- og beslutningsstøtte og fagsystemer i helsetjenesten. For å legge til rette for bedre informasjonsflyt anbefaler Direktoratet for e-helse at helse- og omsorgssektoren benytter internasjonale standarder.
Gevinster
Dersom mange aktører tar i bruk de samme standardene, vil det gi flere fordeler:
- Deling av legemiddelinformasjon blir mer sømløs Dette kan føre til mindre manuell håndtering, som dobbeltføring, klipp og lim, for helsepersonell. Felles standarder legger til rette for dataflyt mellom ulike løsninger og aktører. Det vil bli mulig å dele data på tvers av landegrenser.
- Samlet blir det mindre behov for vedlikehold, forvaltning og mapping av legemiddelinformasjon. Felles standarder bidrar til at aktører i større grad kan gjenbruke arbeid som er utført av andre.
- Det vil legge til rette for automatisert innrapportering til registre. Felles standarder kan fjerne behovet for å tilpasse og samkjøre informasjon fra ulike kilder, og mellom kilde til register.
- Det vil legge til rette for visning av sanntidsdata og kunstig intelligens. Felles standarder legger til rette for dataflyt mellom ulike løsninger og aktører. Store datasett kan samles fra ulike kilder, noe som gir muligheter for ny bruk og kobling av data.
- Felles standarder gjør det enklere å anskaffe og bytte systemer og tjenester. Bruk av internasjonale standarder gjør det enklere å ta i bruk systemer og tjenester, for eksempel beslutningsstøtte, som er utviklet i andre land.
- Det vil virke positivt på innovasjon og næringsutvikling. Ved å bruke internasjonale standarder kan norske leverandører lage systemer og løsninger som både kan brukes i Norge og i andre land.
Etter hvert som vi får erfaring med bruk i Norge, vil Direktoratet for e-helse, sammen med andre etater i helseforvaltningen, helsetjenesten og helsenæringen lage retningslinjer for hvordan standardene skal brukes.
Anbefalinger og tiltak
Direktoratet for e-helse anbefaler bruk av forskjellige standarder til ulike bruksområder, se avsnitt med liste over anbefalte standarder lenger ned på denne siden.
For å kunne ta ut gevinstene som ligger i å bruke internasjonale standarder, er det nødvendig at disse innføres på lik måte i hele helse- og omsorgssektoren.
Sammen med relevante aktører ønsker Direktoratet for e-helse å utarbeide HL7 FHIR områdeprofiler for de viktigste bruksområdene på legemiddelområdet. Dette inkluderer å bestemme felles informasjonsmodeller, kodeverk/terminologi og format/syntaks. Direktoratet for e-helse ønsker også å utrede mulig fellesløsning for legemiddelgrunndata, og å kartlegge hvor det brukes standarder som ikke lenger egner seg. Dette er nærmere beskrevet i et avsnitt om tiltak og videre arbeid lenger ned på denne siden.
Hva kan du gjøre?
Direktoratet for e-helse ønsker at helseforvaltningen, helsetjenesten og helsenæringen jobber sammen for å sikre vi god digital samhandling og trygg og effektiv legemiddelbruk.
Dette kan for eksempel gjøres ved å:
- Engasjere seg i arbeid med standardisering internasjonalt.
- Identifisere hvilke standarder som er relevant for det enkelte prosjekt. Ved behov, ta opp valg av standarder med Direktoratet for e-helse og andre aktører før beslutning.
- Ta i bruk internasjonale standarder og løsninger som følger internasjonale standarder, heller enn å utvikle egne datasett, informasjonsmodeller og kodeverk
- Still krav til leverandøren om bruk av internasjonale standarder ved anskaffelser av nye løsninger
- Bidra nasjonalt med utvikling av HL7 FHIR områdeprofiler for legemiddelområdet.
Inndeling av legemiddelområdet
Legemiddelinformasjon oppstår og brukes i ulike deler av legemiddelområdet. Vi har delt inn legemiddelområdet i en verdikjede i fire steg for å illustrere dette, se Figur 1.
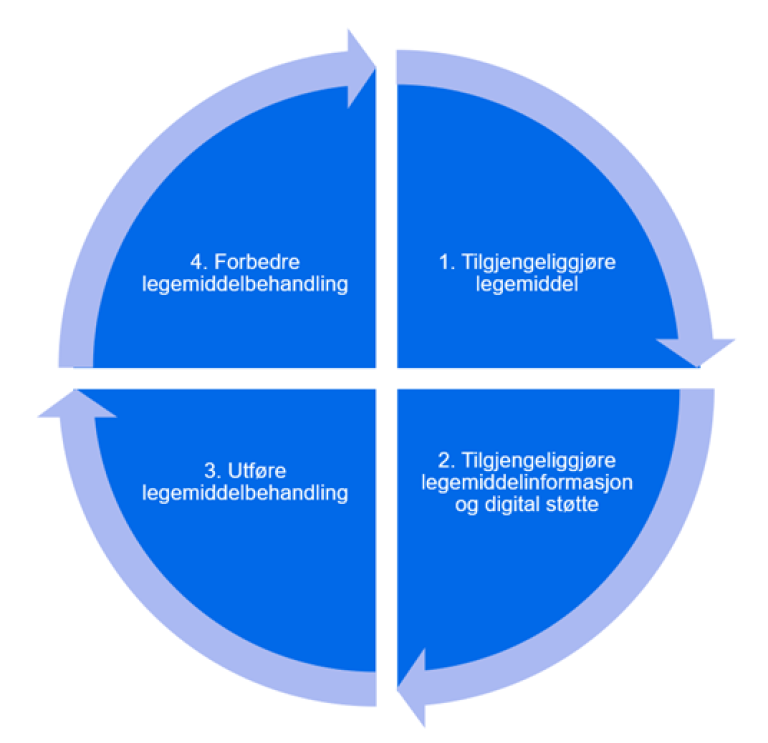
Steg 1 – Tilgjengeliggjøre legemiddel
Utvikling og godkjenning av legemidler, finansieringsløsning for bruk av legemidlene, samt forsyning av legemidler.
Det første steget i verdikjeden handler om å gjøre legemidlene tilgjengelige for innkjøp og behandling av pasienter. For å få til dette må det finnes aktører som kan utvikle legemidler, godkjenne de og sørge for at de leveres på det norske markedet på en trygg måte. Siden vi i Norge har offentlig finansiering av en stor del av legemiddelbehandlingen, er det også ofte en forutsetning at legemidlene har en finansieringsløsning før de kan tas i bruk.
Aktører i dette steget inkluderer blant andre legemiddelindustri, Statens Legemiddelverk, Beslutningsforum, sykehusinnkjøp, grossister og apotek.
Steg 2 – Tilgjengeliggjøre legemiddelinformasjon og digital støtte
Strukturert legemiddelinformasjon, kunnskaps-, prosess- og beslutningsstøtte og støtte til samhandling mellom systemer, helsepersonell og innbygger.
Det andre steget i verdikjeden er å tilgjengeliggjøre legemiddelinformasjon og digital støtte, slik at helsepersonell og innbygger har tilstrekkelig informasjon om legemidlene og god digital støtte for å kunne utføre legemiddelbehandling. Mye av legemiddelinformasjonen oppstår i steg 1 ved godkjenning, forsyning og finansiering av legemidlene. Antall legemidler og kompleksiteten i behandlingen med legemidler er økende, blant annet på grunn av større grad av spesialisering og persontilpasset medisin. Dette gir økt behov for kunnskapsstøtte og beslutningsstøtte.
I tillegg trengs digital støtte i arbeidsprosesser knyttet til legemiddelbehandling og støtte for samhandling. Dette gjelder for eksempel i bytte av omsorgsnivåer, eller for at ulike behandlere skal kunne dele legemiddelopplysninger med hverandre, apotek og pasient.
Aktører i dette steget inkluderer leverandører av legemiddelinformasjon, som Statens Legemiddelverk, Farmalogg. Leverandører av kunnskaps- og beslutningsstøtte, som Legemiddelhåndboka, Felleskatalogen, Helseblibioteket, Helsedirektoratet, FHI og Medbase. Aktører regionalt som tilpasser legemiddelinformasjon, som leverandører av EPJ, kurve, logistikk- og apoteksystemer
Steg 3 – Utføre legemiddelbehandling
Legemiddelbehandling av den enkelte pasient. Det inkluderer å kartlegge og bestemme legemiddelbehandling, fremskaffe og klargjøre legemiddel, administrere legemiddel og følge opp legemiddelbehandlingen.
Det tredje steget i verdikjeden er å utføre behandling med legemidler for bedre helse og livskvalitet for den enkelte pasient. Prosessene knyttet til dette steget og aktørene som er involvert vil være nokså forskjellig avhengig av omsorgsnivå. For eksempel vil prosessen for en pasient innlagt på sykehus sammenlignet med innbygger som kjøper reseptfritt legemiddel til egenbehandling være ulik. Behovet for legemiddelinformasjon vil også være ulikt i de ulike prosessene.
Aktører i dette steget inkluderer alle nivåene av helsetjenesten som er involvert i legemiddelbehandling. For eksempel spesialisthelsetjeneste, kommunal omsorg, private klinikker og institusjoner, apotek, helsepersonell, pasienter og pårørende.
Steg 4 – Forbedre legemiddelbehandling
Bivirkningsovervåkning, legemiddelstatistikk og helsedata, samt styring og forvaltning av legemiddelområdet.
Det fjerde steget i verdikjeden er å lære av erfaringer og observasjoner fra utført legemiddelbehandling. Dette brukes til å gjøre tilpasninger i de andre stegene, som igjen gir bedre legemiddelbehandling for kommende pasienter. For å oppnå dette trengs statistikk og helsedata, og at dataene blir brukt til analyse, forskning og kvalitetsforbedring. Dette inkluderer overvåkning av effekt, bivirkninger og sikkerhet til legemidler. I tillegg behøves styring og forvaltning for å kunne påvirke prosesser i alle fire stegene i verdikjeden. Eksempler på dette er lovgivning, utdanning og normerende produkter.
Aktører i dette steget inkluderer alle som lager statistikk og helsedata med legemiddelinformasjon, og aktører som bruker denne informasjonen til styring og kvalitetsforbedring. Eksempel på aktører er Helsedirektoratet, Folkehelseinstituttet, Statens Legemiddelverk, Direktoratet for e-helse, nasjonale registre, kvalitetsregistre, helsetjenesten og legemiddelindustri.
For å nå målet om trygg og effektiv legemiddelbruk er det nødvendig at legemiddelinformasjon deles og gjenbrukes innad i og mellom disse stegene, altså at det er god digital samhandling på hele legemiddelområdet.
Hva er digital samhandling?
Digital samhandlingsevne er evnen til å samarbeide om informasjon ved å dele og gjenbruke data, løsninger og tjenester.
For å få til god digital samhandlingsevne er det nødvendig med enighet, felles forståelse og støtte i alle lag i rammeverk for digital samhandling (EIF-modellen i Figur 2).
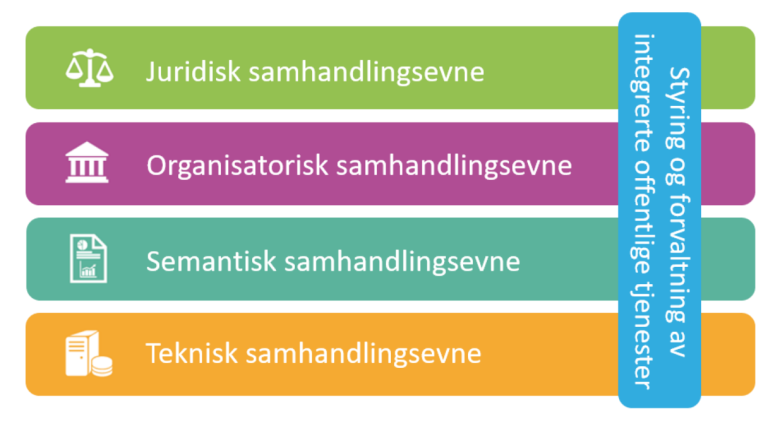
Denne veilederen handler om bruk av internasjonale standarder for semantisk samhandlingsevne på legemiddelområdet.
Det er tre elementer som er sentrale for semantisk samhandlingsevne:
- Felles informasjonsmodeller
- Felles kodeverk og terminologi
- Felles syntaks og format
Informasjonsmodeller beskriver innhold og kontekst av informasjonen det skal samhandles om. Modellene skal i størst mulig grad ta utgangspunkt i internasjonale standarder for både generelle og spesifikke bruksområder. Eksempler er HL7 FHIR (Fast Health Interoperability Resources), ISO IPS (International Patient Summary) og ISO IDMP (IDentification of Medicinal Products).
Kodeverk og terminologi er kodede begreper, klassifikasjoner og identifikatorer som brukes i informasjonsmodeller for den enkelte bruksområde. Det benyttes i dag mange forskjellige terminologier og kodesett, både internasjonale og nasjonale. Eksempler er administrative kodeverk som landkoder, ATC (anatomical, therapeutic, chemical classification), ICPC-2 (International Classification of Primary Care) og SNOMED CT (Systematized Nomenclature of Medicine – Clinical Terms). Eksempler på identifikatorer er fødselsnummer og produktkoder.
Syntaks og format er hvordan innholdet, det vil si informasjonsmodeller, kodeverk og terminologi, er formatert teknisk for overføring. Eksempel er HL7 FHIR sammen med JSON (JavaScript Object Notation) og XML (extensible markup language).
Kategorisering av standarder
Vedlegg A viser relevante standardiseringsorganisasjoner og Vedlegg B Oversikt over Internasjonale standarder for legemiddelinformasjon. Tabellen i vedlegg B beskriver kort bruksområdet til standardene, status for utvikling, føringer for bruk av standarden og om vi kjenner til områder der standarden er tatt i bruk.
Vi har kategorisert de internasjonale standardene for legemiddelinformasjon i informasjonsmodeller, kodeverk og terminologi og format/syntaks. Standardene for kodeverk og terminologi er ytterligere delt inn i tre deler:
- Egenskaper: Koder og begreper som beskriver egenskaper ved legemidlet, for eksempel substanser (innhold), legemiddelform og styrke
- Identifikatorer: Koder som brukes for å identifisere et produkt, for eksempel Global Trade Item Number (GTIN) - GS1
- Behandlingsrelatert informasjon: Koder og begreper som knyttes til et legemiddel og pasientens legemiddelbruk, for eksempel indikasjon, diagnose, symptomer, bivirkning eller funn
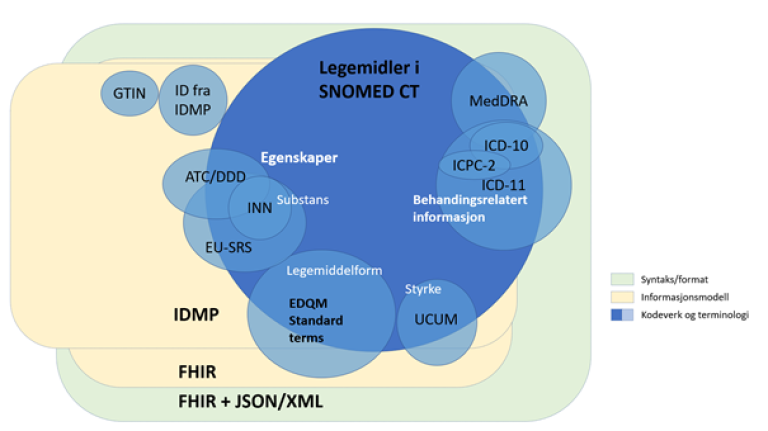
Figur 3 viser at ulike kodeverk og terminologi kan inngå i informasjonsmodellen til ISO IDMP og HL7 FHIR, og utveksles ved hjelp av HL7 FHIR. Figuren viser også hvordan ulike kodeverk og terminologi kan deles inn i egenskaper, identifikatorer og behandlingsrelatert informasjon. Der de blå sirklene overlapper, er det semantisk overlapp mellom kodeverk og terminologi. Dette vil si at begrepet har den samme eller tilnærmet samme meningen selv om den er representert i ulike kontekster og for ulike bruksområder.
Forventet utvikling
God samhandling på legemiddelområdet er prioritert både internasjonalt og nasjonalt. Det forventes at flere utfordringer vil løses på europeisk eller globalt nivå.
Internasjonale standarder vil utfylle hverandre
De internasjonale standardiseringsorganisasjonene samarbeider i større grad enn tidligere og anser hverandre som samarbeidspartnere. I stedet for at samme standard skal løse alle behovene, ser de på hvordan standardene skal utfylle hverandre.
Det er flere eksempler på dette:
- Joint Initiative Council (JIC) er et samarbeid mellom ni standardiseringorganisasjoner for å få de ulike standardene til å fungere sammen og dermed oppnå bedre samhandling globalt. JIC har publisert et whitepaper om dette. Vaksinepass for covid-19, International Patient Summary, IDMP og Genomics er brukt som eksempler.
- UNICOM er et EU-prosjekt (2020-2024) som handler om å forbedre pasientsikkerheten og gi bedre helsetjenester for alle. Dette gjør de ved å innføre ISO IDMP (IDentification of Medicinal Products) standardene for utvalgte områder. Målet er at legemiddelinformasjon fra godkjenning av produkter skal kunne gjenbrukes i flere deler av legemiddelområdet, for eksempel e-resept på tvers av landegrenser, i kliniske systemer og for legemiddelovervåkning. UNICOM har utarbeidet en GAP-analyse som identifiserer områder der det er hindringer for deling av legemiddelinformasjon. UNICOM jobber for å fjerne disse hindringene, blant annet ved å foreslå tilpasninger de ulike standardene.
Mapping mellom kodeverk og terminologier
Standardiseringsorganisasjonene binder sammen ulike kodeverk og terminologier med semantisk overlapp (Figur 3) for å lette samhandling. SNOMED Int. inkluderer å være en «terminology integrator» i sin strategi for 2020-2025.
Eksempler på mappinger som er utført eller under planlegging:
- Medical Dictionary for Regulatory Activities (MedDRA) og SNOMED CT
- International Classification of Disease (ICD-10 og ICD 11) og SNOMED CT
- European Directorate for the Quality of Medicines and HealthCare (EDQM) Standard terms og SNOMED CT
Elementer fra ISO IDMP-standardene vil gjenbrukes i hele verdikjeden
Det er flere grunner til at IDMP vil bli en felles informasjonsmodell på legemiddelområdet, der deler av IDMP vil benyttes for ulike formål:
- UNICOM bruker IDMP som en felles standard for legemiddelinformasjon og ser for seg at elementer fra IDMP fra godkjenningen av produktene skal gjenbrukes både til kliniske formål (for eksempel forskrivning) og til overvåkning av legemidler
- Legemiddelinformasjon fra godkjenning av legemiddel i EU/EØS vil bli tilgjengelig for videre bruk. Europeiske legemiddelmyndigheter (EMA) utvikler tjenesten SPOR (Substance, Product, Organisation, Referensials), som er basert på IDMP-standardene. SPOR benytter kodeverk fra EQDM Standard terms, European substance registration system (EU-SRS), ATC og en rekke andre kodeverk for å beskrive legemidlene
- Prosjektet Ny digital plattform for legemiddelinformasjon ved Statens legemiddelverk utvikler en ny legemiddeldatabase i henhold til IDMP og med en portal mot SPOR-databasene. Prosjektet utvikler en fleksibel distribusjonstjeneste basert på internasjonale standarder, se beskrivelse av prosjektet på Digitaliseringsdirektoratet (Digdir) sine nettsider.
- Legemiddelinformasjon i SNOMED CT er kompatibel med IDMP, det vil si at det er mulig å lage bindinger mellom standardene.
- ISO-standarder for spesifikke anvendelser, for eksempel produktkataloger (ISO 19256), forskrivning av legemiddel (ISO 17523) og utlevering av legemiddel (ISO 19293) benytter deler fra IDMP i sin informasjonsmodell
Tjenester vil bli basert på internasjonale standarder
Økt bruk av internasjonale standarder vil gjøre at tjenester med strukturert legemiddelinformasjon og kunnskap- og beslutningsstøtte kan benyttes i et internasjonalt marked. I tillegg vil kostnader knyttet til å ta i bruk nye systemer og tjenester bli lavere når systemene bruker de samme standardene. Vi forventer derfor at leverandører som tilbyr dette tar i bruk internasjonale standarder og benytter sentrale databaser i produktene sine. Dette forventer vi at vil skje parallelt med at de samme standardene tas i bruk av helse- og omsorgssektoren.
Vi ser tendenser til dette både internasjonalt og nasjonalt:
- UNICOM har flere prosjektpartnere som leverer produktkataloger, og som dermed ser på muligheter for å tilby legemiddelinformasjon som følger IDMP. Se liste over prosjektpartnere i UNICOM.
- Flere produktkataloger tilbyr SNOMED CT i sin legemiddelinformasjon. Eksempler på dette er National Health Service (NHS) i England og Phast i Frankrike
- SAFEST-prosjektet i Legemiddelverket og Program Felles språk i Direktoratet for e-helse utarbeider en mapping mellom dagens produktkatalog for legemidler, forskrivnings- og ekspedisjonsstøtte (FEST) og SNOMED CT. Legemiddelinformasjonen i SNOMED CT skal benyttes av Helseplattformen i Midt-Norge
Anbefalte standarder
Direktoratet for e-helse anbefaler bruk av forskjellige standarder til ulike bruksområder.
HL7 FHIR
FHIR anbefales som felles syntaks og informasjonsmodell for deling av legemiddelinformasjon mellom aktører. FHIR gjenbruker andre relevante internasjonale informasjonsmodeller som for eksempel IDMP og IPS for å beskrive kontekst, og kodeverk og terminologi velges for å gi innhold. FHIR anbefales for å oppnå bruk av felles informasjonsmodeller, felles kodeverk og terminologi, samt felles syntaks og format. En forutsetning for å få til dette, er at aktørene i helse- og omsorgssektoren er med på å utarbeide områdeprofiler for ulike bruksområder der legemiddelinformasjon er sentralt.
IDMP
IDMP anbefales for å beskrive produktspesifikk informasjon. Identifikatorer fra IDMP anbefales i hele verdikjeden for legemidler. Dette legger til rette for felles identifikasjon og internasjonal utveksling av legemiddelinformasjon som er knyttet til produkter.
SNOMED CT
SNOMED CT anbefales for legemiddelinformasjon som ikke må knyttes til et produkt. Dette gjelder områdene strukturert legemiddelinformasjon, kunnskaps- og beslutningsstøtte og samhandling om legemidler. En forutsetning for denne bruken er at produkter på markedet mappes til legemidler i SNOMED CT. Legemidler i SNOMED CT legger til rette for
- bestilling, visning og deling av legemiddelinformasjon uten knytning til en bestemt merkevare (generisk forskrivning/virkestofforskrivning, legemidler i bruk). Dette gjelder både i behandlingsøyemed og ved deling av helsedata
- Enklere vedlikehold av kunnskaps og beslutningsstøtte
- internasjonal utveksling av legemiddelinformasjon
ATC/DDD
ATC/DDD (Defined Daily Dose)-systemet anbefales som metodologisk verktøy for å analysere legemiddelbruk og utføre farmakoepidemiologiske studier. Vi anbefaler ikke bruk av ATC-systemet som identifikator for beslutningsstøtte, identifisering av finansiering (refusjon) eller terapeutisk bytte, da ATC ikke er tilrettelagt for dette. Se WHO collaborating center (WHOCC) sin beskrivelse av bruksområdene for ATC.
GTIN
GTIN fra GS1 (strekkode) anbefales i hele forsyningskjeden for legemidler sammen med ID fra IDMP. Dette er for å legge til rette for sporing av legemidler, for eksempel i «lukket legemiddelsløyfe», oversikt over tilgjengelige produkter (beredskap, legemiddelmangel) og tilbaketrekking av produkter ved kvalitetssvikt.
UCUM
UCUM anbefales for utveksling av måleenheter. Dette er for å kunne støtte automatisk omregning av måleenheter, for eksempel mellom milliliter og liter.
Gjenbruke kodeverk og terminologi i bruk
For behandlingsrelatert legemiddelinformasjon anbefales gjenbruk av kodeverk og terminologi som benyttes av helsepersonell, for eksempel ICD-10 eller SNOMED CT. Dette er for å unngå at helsepersonell må benytte flere standarder for å kode informasjon. Et eksempel er koding av diagnose. Her bør helsepersonell kunne registrere en diagnose som både kan brukes i journal og samtidig brukes til å bestemme om pasienten skal få finansiert legemidlet på blå resept.
Anbefalte tiltak og videre arbeid
For å kunne ta ut potensialet som ligger i å innføre internasjonale standarder, er vi avhengig av at standardene innføres på en lik måte i hele helse- og omsorgssektoren.
Dette forutsetter at Direktoratet for e-helse, andre etater i helseforvaltningen, nasjonal tjenesteleverandør (Norsk helsenett), helsetjenesten og helsenæringen samarbeider om følgende tiltak:
- Utarbeide FHIR områdeprofiler for de viktigste bruksområdene på legemiddelområdet. Dette inkluderer å bestemme felles informasjonsmodeller, kodeverk/terminologi og format/syntaks. For informasjon om hvordan områdeprofiler skal utvikles se metode for utvikling av HL7 FHIR områdeprofiler på ehelse.no.
- Utrede fellestjeneste for enhetlig og strukturert legemiddelinformasjon (legemiddelgrunndata)
- Kartlegge hvor det benyttes nasjonale eller proprietære standarder eller standarder som benyttes til formål som de ikke egner seg til. Det bør deretter vurderes om bruken skal endres eller om standarden skal fases ut.
Bibliografi
I tillegg til anbefalingene i denne veilederen gjelder også anbefalingene i følgende normerende produkter:
- Målarkitektur for datadeling (Direktoratet for e-helse, 2021)
- Retningslinje for SNOMED CT (Direktoratet for e-helse, 2021)
- Veileder for helse- og omsorgssektoren: Bruk av Digitaliseringsdirektoratets "Overordnede arkitekturprinsipper for digitalisering av offentlig sektor" (Direktoratet for e-helse, 2020)
Følgende dokumenter setter rammebetingelser for denne veilederen:
- Plan for internasjonale standarder (Direktoratet for e-helse, 2021)
- Legemiddelmeldingen (Meld. St. 28, Helse og omsorgsdepartementet, 2015)
- En innbygger en journal (Direktoratet for e-helse. Nettside som oppsummerer arbeidet som er gjort per 2021)
- Nasjonal e-helsestrategi 2017-2022
| Organisasjon | Beskrivelse |
| ISO | The International Organization for Standardization ISO - International Organization for Standardization |
| ISO/TC 215 Health informatics | ISO-komite som arbeider spesifikt med helseinformatikk ISO - ISO/TC 215 - Health informatics |
| CEN | European Committee for Standardization European Standards - CEN-CENELEC (cencenelec.eu) |
| Standard Norge | Standard Norge er Norges medlem i CEN og ISO og utvikler og forvalter mange ulike standarder. Standard Norge | standard.no |
| SN/K 587 E-helse | Komite i Standard Norge som arbeider spesifikt med e-helse |
| SNOMED International | Ideell organisasjon som eier og forvalter SNOMED CT SNOMED - Home | SNOMED International |
| HL7 International | Health Level Seven International Health Level Seven International - Homepage | HL7 International |
| WHO | World Health Organization. Utgiver av ICD-kodeverket WHO | World Health Organization |
| WONCA | World Organization of Family Doctors. Utgiver av ICPC-kodeverket http://www.globalfamilydoctor.com/ |
| MSSO | Maintenance and Support Services Organization. Utgiver av Medical Dictionary for Regulatory Activities (MedDRA) Organisation | MedDRA |
| IHE | Integrating the Healthcare Enteprise (IHE) Organisasjonen IHE fremmer bruk av standarder for bedre samhandling i helse- og omsorgssektoren. De lager anbefalinger for hvordan etablerte standarder skal brukes sammen for ulike bruksområder, inkludert legemiddelområdet (ihe.org). IHE er også en aktør som er bidrar i testing av standarder og sertifisering av systemer. Integrating the Healthcare Enterprise (IHE) - IHE International |
| EDQM | European Directorate for the Quality of Medicines EDQM - European Directorate for the Quality of Medicines |
Vedlegg B: Oversikt over internasjonale standarder for legemiddelinformasjon
Informasjonsmodeller
| Navn | Beskrivelse |
| ISO IDMP Health informatics — Identification of medicinal products ISO 11238 Data elements and structures for the unique identification and exchange of regulated information on substances ISO 11239 Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging ISO 11240 Data elements and structures for the unique identification and exchange of units of measurement ISO 11616 Data elements and structures for unique identification and exchange of regulated pharmaceutical product information ISO 11615 Data elements and structures for the unique identification and exchange of regulated medicinal product information | Fem standarder for beskrivelse og identifisering av medisinske produkter (legemidler) Modellen omfatter informasjon om legemidlets navn, innhold, legemiddelform og styrke for produsert og administrerbart legemiddel. I tillegg omfatter modellen informasjon om regulativ godkjenning av produktet, kliniske egenskaper og innpakning Utviklet for å kunne følge livsløpet til et legemiddelprodukt: Utvikling, godkjenning, bruk og overvåkning Føringer: Obligatorisk for utveksling av legemiddelinformasjon ved godkjenning og oppfølging av produktinformasjon i EU/EØS - Commission Implementing Regulation (EU) No 520/2012 |
| ISO 27269:2021 Health informatics — International patient summary | Felles informasjonsmodell for deling av en pasients oppsummerende opplysninger Føringer: Anbefalt av Direktoratet for e-helse (veileder) som overordnet rammeverk for strukturering og utveksling av oppsummerende pasientopplysninger |
| ISO/TS 17251:2016 Health informatics — Business requirements for a syntax to exchange structured dose information for medicinal products | Krav til syntaks for utveksling av dosering av legemidler |
| ISO 17523 Health informatics — Requirements for electronic prescriptions | Krav til elektronisk forskrivning |
| ISO/TS 19256 Health informatics — Requirements for medicinal product dictionary systems for health care | Krav til produktkataloger for legemiddel |
| ISO/TS 19293 Health informatics — Requirements for a record of a dispense of a medicinal product | Krav til dokumentasjon av utlevering av legemiddel |
| ISO/TS 22703 Health informatics — Requirements for medication safety alerts | Krav til systemer som gir varsel knyttet til legemidler og legemiddelbruk |
| ISO/TS 22756 Health Informatics — Requirements for a knowledge base for clinical decision support systems to be used in medication-related processes | Krav til kunnskap som skal inngå i beslutningsstøtte om legemidler og legemiddelbruk |
| HL7 FHIR | Felles informasjonsmodell som definerer dataelementer og relasjoner for utveksling av helseopplysninger, herunder legemiddelbruk og informasjon om legemidler Føringer: Anbefaling om bruk av HL7 FHIR for datadeling (retningslinje), Direktoratet for e-helse, 2019 |
Kodeverk og terminologi for egenskaper ved legemidler
| Navn | Beskrivelse |
| SNOMED CT | Legemiddelhierarkiet i SNOMED CT er utviklet for å støtte samhandling i pasientbehandling og analyse av helsedata. Det er tre nivåer som beskriver legemidlene: Medicinal product (MP); Legemiddelhierarkiet utvides nasjonalt til å inkludere eller mappe til ekte/godkjente produkter og pakninger. Kompatibel med IDMP Føringer: Retningslinje for bruk av SNOMED CT i Norge, Direktoratet for e-helse, 2021 |
| EU-SRS European Substance Registration System | Presis beskrivelse av substanser i henhold til IDMP til bruk i godkjenning og oppfølging av legemidler. Standarden er under utvikling |
| Standard Terms fra European Directorate for the quality of medicines (EDQM) | Standard terms omfatter begreper og definisjoner for å beskrive legemiddelform, administrasjonsmetode og administrasjonsvei, innpakning, inkludert lukning og utstyr for administrasjon av legemidler og enheter for presentasjon (unit of presentation) Føringer: «Standard terms» fra EDQM må benyttes for legemiddelform ved godkjenning av legemidlene |
| ATC/DDD-systemet fra WHO CC The Anatomical Therapeutic Chemical (ATC) classification system Defined Daily Dose (DDD) WHO Collaborating Centre for Drug Statistics Methodology | ATC/DDD er WHOs klassifikasjon av legemidler til bruk som metodologisk verktøy for å analysere legemiddelbruk og utføre farmakoepidemiologiske studier. I ATC-klassifiseringssystemet er de aktive innholdsstoffene klassifisert i et hierarki med fem ulike nivåer. ATC muliggjør aggregering i terapeutiske/farmakologiske og kjemiske grupper til statistiske formål som å følge legemiddelforbruket over tid. DDD er en verdi og måleenhet knyttet til en ATC-kode og administrasjonsvei. DDD kvantifiserer legemiddelforbruk uavhengig av pris, styrke og pakninger Føringer: Obligatorisk. Eksempler: Blåreseptforskriften, Forskrift om Reseptregister |
| International Nonproprietary Names for substances (INN) | Unike generiske navn på farmasøytiske virkestoff og ingredienser Føringer: INN benyttes for navngivning av substanser i produktinformasjonen og merking av legemidler. |
| UCUM (Unified Code for Units of Measure) | Enhetlige koder for måleenheter. UCUM er et kodesystem som skal inkludere alle måleenheter som brukes i internasjonal vitenskap, ingeniørfag og næringsliv. Formålet er å legge til rette for entydig elektronisk samhandling av mengder sammen med sine enheter. Føringer: Anbefalt eller obligatorisk. Eksempler: Benyttes med IDMP, HL7 FHIR, IPS FHIR IG med flere. |
Identifikatorer for legemidler
| Navn | Beskrivelse |
| IDMP: PCID, MPID, PhPID | Identifikator for pakning (PCID), godkjent produkt (MPID) og bruksklart produkt uavhengig av leverandør (PhPID) |
| GTIN (Global Trade Item Number) fra GS1 | Fire nivåer for å identifisere og spore medisinske produkter ved hjelp av strekkode, fra ytre til indre emballasje. Kan kobles til IDMP-beskrivelse av produkter Føringer: Direktoratet for e-helse anbefaler å ta i bruk GS1 GTIN for identifikasjon av legemiddel |
Kodeverk og terminologi for pasient og legemiddelbruk
| Navn | Beskrivelse |
| SNOMED CT | Diagnose, funn og symptomer, med mer Føringer: Anbefalt Retningslinje for bruk av SNOMED CT i Norge, Direktoratet for e-helse, 2021 |
| MedDRA (Medical Dictionary for Regulatory Activities) | MedDRA inneholder begreper som benyttes i godkjenning og overvåkning av legemidler, for eksempel indikasjon og bivirkning, og benyttes i internasjonalt samarbeid om legemiddelovervåkning. Obligatorisk |
| ICD-10 | Diagnose, funn og symptomer Føringer: Obligatorisk. Les mer i Referansekatalogen for e-helse |
| ICD-11 | Diagnose, funn og symptomer Ingen føringer pr. dags dato |
| ICPC-2 | Diagnose, funn og symptomer Føringer: Obligatorisk: Les mer i Referansekatalogen for e-helse |
Syntaks og format
| Navn | Beskrivelse |
| HL7 FHIR | Data formatert som XML/JSON og strukturert etter informasjonsmodellene i HL7 FHIR. Føringer: Anbefaling om bruk av HL7 FHIR for datadeling (retningslinje), Direktoratet for e-helse, 2019 |